Resumen de los Estados de la Materia y Sus Propiedades Cuadro Sinóptico
Resumen De Los Estados de la Materia- Sus Propiedades - Cuadro Sinóptico
¿QUE ES LA MATERIA?
Hace miles de millones de años, el Universo estaba reducido a un pequeño volumen con densidad y temperatura infinitas. Luego de la Gran Explosión (Big Bang) , materia y energía se expandieron, formando poco a poco el Universo tal como lo conocemos.
¿Pero qué es la materia? ¿Y la energía?. Estos dos términos, materia y energía, están incorporados a nuestro lenguaje cotidiano, sin embargo, cuando queremos definirlos las cosas se complican.
La manera más aproximada de definir la materia es decir que es todo aquello que tiene masa, que ocupa un lugar en el espacio y que es perceptible, o sea, que puede impresionar directa o indirectamente nuestros sentidos."
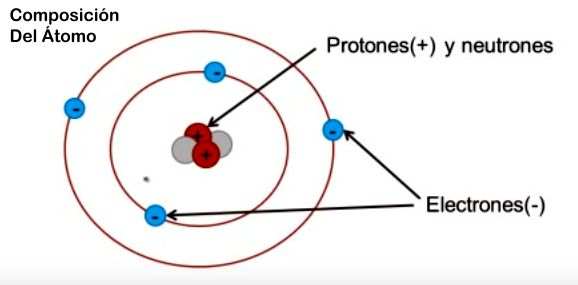
Si pudieramos introducirnos dentro de la materia demuestraríamos que la misma está constituida por estructuras infinitamente pequeñas, los átomos.
En el átomo pueden distinguirse una parte central o núcleo, formada por dos tipos de partículas subatómicas, los neutrones y los protones, y rodeada por una nube de otras partículas subatómicas, los electrones, que se desplazan alrededor del núcleo en regiones del espacio llamadas orbitales.(sobre esto hablaremos mas abajo).
Esquema Basico del Atomo
Todo el Universo está formado por materia. Una porción limitada de materia constituye un cuerpo.
La materia está formada, en general, por una mezcla más o menos compleja de diferentes sustancias.
El aire que respiramos, el agua que bebemos, prácticamente todo lo que nos rodea en la vida es materia compleja, aunque a veces pueda parecer lo contrario.
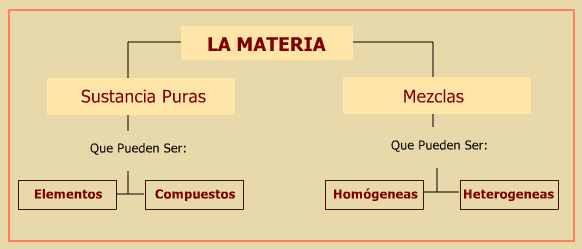
Existen muy pocos casos en la naturaleza de materia pura, es decir, formada por una única sustancia.
Sustancia pura es aquella clase de materia que no puede descomponerse en otras mas elementales por procedimientos fisicos sencillos y mantienen sus composición y propiedades quimicas y físicas constantes como el color, olor, conductividad, densidad, etc..
Mediante métodos físicos y químicos de purificación (destilación, extracción con disolventes, cristalización, etc.) es posible identificar si una clase de materia es o no una sustancia pura. Si una muestra de materia o una parte de ella no cambia sus propiedades tras someterla a uno o varios procesos de purificación, se puede afirmar que es materia pura.
Las sustancias puras no suelen encontrarse solas, sino formando mezclas:
Una mezcla es la reunión de dos o más sustancias puras que permanecen en contacto, sin que entre ellas ocurra una reacción química.
a) Si los componentes de la mezcla no se pueden distinguir, por ejemplo el aire, el agua de mar, la gasolina, una taza de chocolate, se dice que la mezcla es homogenea.
b) En el caso que en la mezcla se puedan distinguir sus componentes, por ejemplo un guiso de arroz, decimos que la mezcla es heterogenea.
Resumiendo, la materia está formada por sustancias puras o mezclas, las primeras pueden ser elementos químicos como el hierro, plomo, calcio, etc. o bien compuestas como el agua pura (H2O), la sal (ClNa), etc. Las mezclas pueden ser homogeneas u heterogeneas.
Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. Un árbol, el aire, una roca, tu libro escolar y un ser humano son cuerpos materiales.
La masa es definida como la cantidad de materia que contiene un cuerpo. La unidad de masa que se usa en química es el gramo (g).
La masa y el peso están relacionados.
El peso es la fuerza de atracción que ejerce la gravedad de la Tierra sobre la masa de los cuerpos. Esto significa que el peso y la masa no son iguales.
La masa permanece constante pero el peso varía de acuerdo con la gravedad de los cuerpos.
El volumen de un cuerpo corresponde al espacio tridimensional que ocupa. Las sustancias como los líquidos y los gases tienen la propiedad de escurrirse con facilidad, es decir, de tomar la forma del recipiente que los contiene. Esta propiedad se llama fluir, por lo cual se les ha llamado a los gases y a los líquidos fluidos.
![]()
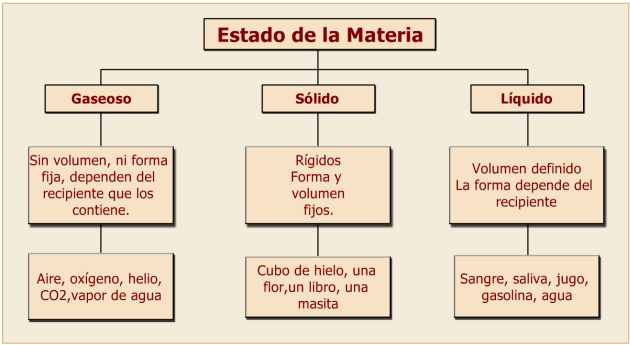
Estados Físicos de la Materia: Sólido, Líquido y Gaseoso
En la naturaleza, la materia puede presentarse en uno de los tres estados fundamentales, conocidos como estados físicos:
• Un cuerpo es sólido cuando tiene forma y volumen definidos.
• Un líquido tiene un volumen definido pero forma indeterminada (pues adopta la forma del recipiente que lo contiene).
• Un cuerpo es gaseoso cuando no tiene ni forma ni volumen definidos (porque adopta la forma y el volumen del recipiente que lo contiene y, si está libre, se expande indefinidamente).
PROPIEDADES DE LOS SÓLIDOS:
• Tienen forma propia y, algunos, regular.
• Prácticamente no se comprimen, por lo cual su volumen es constante.
• Su densidad es bastante próxima a la de los líquidos.
• No fluyen.
PROPIEDADES DE LOS LÍQUIDOS:
• Adoptan la forma del recipiente que los contiene.
• Se comprimen con dificultad, por lo que su volumen es prácticamente constante.
• Son más densos que los gases.
• Pueden fluir.
PROPIEDADES DE LOS GASEOSOS:
• No tienen forma propia.
• Se comprimen con facilidad y se expanden llenando el volumen del recipiente que los contiene.
• Sus densidades son muy bajas comparadas con las de los líquidos y sólidos.
• Pueden fluir.
• Ejercen fuerzas sobre todas las paredes del recipiente que los contiene.
![]()
CUADROS SINÓPTICOS SOBRE LOS ESTADOS DE LA MATERIA
Una misma sustancia y tres estados diferentes:
La materia se presenta, según la disposición y el comportamiento de sus moléculas, en tres estados posibles, conocidos como estados de agregación: sólido, líquido y gaseoso.
Estado sólido.
Las moléculas de los sólidos se disponen según un ordenamiento regular y se mantienen fuertemente unidas, por lo que sólo pueden vibrar alrededor de posiciones fijas.
Los cuerpos sólidos son incompresibles (no se pueden comprimir, es decir, su volumen no disminuye aunque sobre ellos se apliquen fuerzas muy grandes), tienen forma propia y propiedades específicas.
Por ejemplo, la ductilidad (algunos sólidos se pueden estirar hasta formar alambres o hilos); la maleabilidad (algunos metales, al ser extendidos, forman placas o láminas); la tenacidad (oponen resistencia a romperse o deformarse cuando se los golpea) y el punto de fusión (temperatura a la cual pasan al estado liquido).
Estado líquido.
Las moléculas de los líquidos se disponen de manera desordenada, y su fuerza de cohesión es menor que la de los sólidos, por lo que se mueven al azar, muy lentamente.
Al igual que los sólidos, los cuerpos líquidos son incompresibles. Pero, a diferencia de los sólidos, no tienen forma propia, es decir, adoptan la forma del recipiente que los contiene.
Entre las propiedades específicas de los líquidos cabe mencionar la viscosidad, o capacidad de fluir más o menos lentamente (el aceite, por ejemplo es un líquido más viscoso que el alcohol y fluye más despacio); la volatilidad, o capacidad de evaporarse con mayor o menor facilidad (por ejemplo, al abrir un frasco de éter se percibe el olor, pues es un líquido muy volátil), y el punto de ebullición (temperatura a la cual pasan al estado gaseoso).
Estado gaseoso.
La fuerza de cohesión entre las moléculas de los gases es muy débil, y éstas tienden a separarse unas de otras (se mueven al azar, muy rápidamente).
Todos los cuerpos gaseosos son compresibles, es decir, su volumen disminuye cuando se aplica alguna fuerza sobre ellos.
Además, los gases no tienen forma propia y siempre tienden a ocupar el mayor volumen posible.
Como propiedad específica, se puede definir el punto de licuefacción (temperatura a la cual se condensan, es decir, pasan al estado líquido; este valor coincide con el punto de ebullición).
El estado de agregación se define para una sustancia dada y a una temperatura determinada.
Así, podemos decir que el oxígeno es gaseoso a la temperatura ambiente, el agua es sólida a menos de 4 °C, el vidrio es líquido a más de 1.200 °C, etcétera.
![]()
Cambios de Estado de la Materia:
A la temperatura ambiente, cada sustancia se encuentra en un estado determinado; el agua es líquida, el oxígeno es gaseoso, el hierro es sólido. Pero a otras temperaturas, las sustancias cambian de estado: el agua puede ser sólida; el mercurio, gaseoso, y el oxígeno, líquido, por ejemplo.
Así pues, la materia cambia de estado según la temperatura a la que se encuentra.
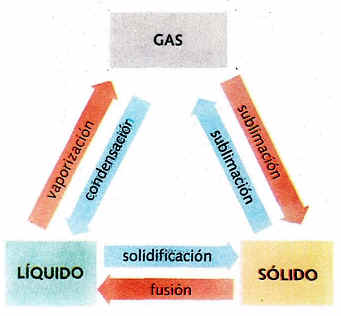
A continuación aparecen los nombres de los diferentes cambios de estado:
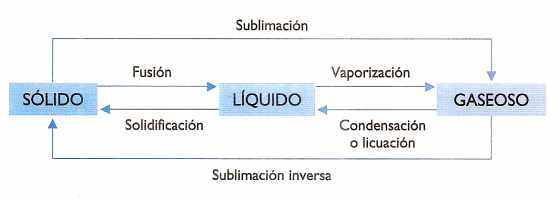
Los cambios de estado que se producen por absorción de calor se denominan progresivos, y aquellos que al producirse desprenden calor se llaman regresivos.
Los cambios de estado se pueden esquematizar de la siguiente manera:
1. Fusión. Pasaje del estado sólido al líquido.
2. Vaporización. Pasaje del estado líquido al gaseoso. Cuando se verifica a través de la superficie libre.se denomina evaporación; en cambio, cuando tiene lugar en toda la masa de un líquido se llama ebullición.
3. Volatilización. Pasaje del estado sólido al gaseoso, sin pasar por el estado líquido.
4. Sublimación. Pasaje del estado gaseoso al sólido sin pasar por el estado líquido. Algunos autores emplean este término para definir también el camino inverso, es decir, la volatilización.
5. Solidificación. Pasaje del estado líquido al sólido.
6. Licuefacción. Pasaje del estado gaseoso al estado líquido.
Sabemos que es posible encontrar estas sustancias en otro estado distinto del habitual.
¿De qué factores depende el que una sustancia se encuentre en un estado físico determinado?
• En primer lugar depende, evidentemente, del tipo de sustancia que estemos considerando.
• También depende de la temperatura: calentando se puede transformar en vapor toda el agua de una cacerola; enfriando, esa misma agua se puede transformar en hielo.
• La presión es el tercer factor a tener en cuenta. Si se somete una sustancia a grandes presiones, se puede conseguir que cambie de estado, aunque no se modifique la temperatura.
El gas butano con el que se cocina se encuentra en estado líquido dentro de la garrafa que lo contiene, y se transforma en gas al salir de ella. Esto es debido a que la presión atmosférica es mucho menor que la presión a la que está envasado el butano.
El estado físico en que se encuentra una cierta sustancia depende de la temperatura y de la presión a las que dicha sustancia se encuentra sometida.
Modificando uno de estos dos factores, o los dos, es posible conseguir que la sustancia cambie de estado.
En la figura se representan en un diagrama los posibles cambios de estado y el nombre característico que recibe cada uno de ellos.

- Cuadro cambio de estados de la materia
Es de destacar que el paso de líquido a gas o vaporización puede producirse por dos mecanismos diferentes:
• La evaporación, que tiene lugar a cualquier temperatura y únicamente ocurre en la superficie del líquido.
• La ebullición, que tiene lugar a una temperatura característica de cada sustancia y ocurre en todo el líquido.
![]()
PROPIEDADES DE LA MATERIA
Los distintos materiales se diferencian gracias a ciertas cualidades que afectan en forma directa o indirecta nuestros sentidos y que se denominan propiedades físicas.
Estas propiedades pueden medirse y observarse sin que se modifique la composición la materia. ¿Cómo se clasifican las propiedades físicas?.
Antes de responder a la pregunta, analicen estas dos situaciones sencillas:
1. Al medir la masa de un terrón de azúcar, se comprobó que era diferente de la masa de una bolsa de azúcar.
2. Al observar un grano de azúcar, se comprobó que su color era igual al de un terrón.
En el primer caso, se dice que la masa es una propiedad extensiva, porque depende de la cantidad de materia analizada. Si la cantidad de materia se modifica, se modifica en forma proporcional la propiedad extensiva.
Entre las propiedades extensivas, además de la masa podemos mencionar el volumen (que se define para una presión y una. temperatura determinadas), el calor acumulado por un cuerpo, etc. Las propiedades extensivas son aditivas, es decir que la masa del terrón y la masa de la bolsa se pueden sumar para calcular la masa total de azúcar.
En la segunda situación, se dice que el color del azúcar es una propiedad intensiva, porque no depende de la cantidad de materia analizada, y constituye una característica específica de la materia.
Entre las propiedades intensivas se encuentran:
• La densidad, que es la relación entre masa y volumen en condiciones de presión y temperatura determinadas.
• El índice de refracción, que es el cociente entre la velocidad de propagación de la luz en esa sustancia y la velocidad en un medio de referencia.
• Las temperaturas a las cuales ocurren los cambios de estado (a una presión determinada): el punto de fusión, que es la temperatura a la cual coexisten en equilibrio el estado sólido y el estado líquido, y el punto de ebullición, que es la temperatura a la cual coexisten en equilibrio el estado líquido y el estado gaseoso.
• La dureza de los sólidos, que es la resistencia de un cuerpo a ser rayado o cortado.
• La tensión superficial, referida a los líquidos, que es la cantidad de energía que se requiere para extender o aumentar la superficie de un líquido por unidad de área.
• La elasticidad o capacidad de los cuerpos de deformarse, cuando se aplica una fuerza sobre ellos y de recuperar su forma original al suprimir la fuerza aplicada.
Las propiedades intensivas no son aditivas. Por ejemplo, si registran el punto de ebullición del agua contenida en dos recipientes, y luego juntan el agua de los dos en un solo recipiente y vuelven a registrar el punto de ebullición, éste no cambia.
Por otro lado, las propiedades químicas determinan qué cambios o transformaciones puede experimentar la materia en su composición. Estos cambios ocurren a través le las reacciones químicas.
![]()
NATURALEZA DE LA MATERIA
La naturaleza nos muestra una multitud de objetos distintos formados por diferentes materiales y, a la vez, vemos la desintegración de muchos de estos cuerpos: las montañas sufren la erosión del viento y del agua, que convierten en polvo lo que fueron inmensas piedras, la materia orgánica que forma a los seres vivos se degrada en componentes microscópicos por la acción de bacterias y otros organismos. ¿Hasta qué punto puede llegar en la desintegración de un objeto material?
Si tomamos una hoja de papel y la rompemos una y otra vez obteniendo en cada corte trozos más y más pequeños, ¿hasta dónde podrá continuar el proceso?.
Esta pregunta la formularon los griegos (y probablemente también otras civilizaciones) hace muchos siglos.
Algunos, como Aristóteles, creían que el proceso de división de algo material era infinito, o dicho de otro modo: afirmaban que la materia es continua.
El espacio entre los astros estaría ocupado por la materia más sutil y perfecta: el éter. (Teoría Fracasada)
Pero bien, ¿Cómo está constituida la materia? Esta es una pregunta que ha preocupado siempre al hombre y lo ha hecho meditar muchísimo.
En la antigüedad los griegos pensaron acerca de dos posibilidades: o bien sería posible dividir un trozo de materia una y otra vez, indefinidamente; o bien la materia podría dividirse hasta llegara cierto punto; a este límite lo llamaron átomo, precisamente porque "a — tomo" quiere decir "no — cortable" o "no — divisible".
Leucipo, Demócrito y Epicuro especularon con una estructura atómica de la materia, siglos antes de Cristo; pero en aquella época todo era cuestión de opinión, pues no había medios para comprobar experimentalmente la existencia de lo que hoy conocemos como átomo o como molécula.
Para ello fue necesario llegar a los tiempos modernos.
El químico inglés John Dalton, en 1806, propuso formalmente la teoría atómica para explicar las relaciones cuantitativas en que se combinan ciertos gases. Posteriormente un químico italiano, Amadeo Avogadro, introdujo la idea de molécula.
Uno de los descubrimientos científicos más notables del siglo XX fue que "los átomos no son tales", en el sentido de que sí se los puede dividir, pues están formados por un núcleo, que contiene protones y neutrones y una corteza que contiene a electrones en capas energéticas que giran a su alrededor.
![]()
LOS "LADRILLOS" DE LA MATERIA
Es muy tentadora la idea de que la materia esté constituida por unos pocos elementos.
Hace siglos se pensó que éstos podrían ser el agua, el fuego, la tierra y el aire; más adelante, en el siglo XIX, llegó a afirmarse que todas las sustancias tendrían come base una sola, el hidrógeno, pues las masas atómicas de todos los elementos son, aproximadamente, múltiplos enteros de la mase atómica del hidrógeno.
Pero prontamente se desechó esa hipótesis.
Actualmente la situación se ha aclarado mucho; y una descripción sencilla (útil para comenzar a estudiar el tema pero incompleta) se basa en la existencia de tres clases de partículas componentes fundamentales de la materia: el protón, el neutrón, (ambos son llamados nucleones) y el electrón. (actualmente hay también decenas de partículas mas elementales)
COMPONENTES DEL ÁTOMO
En NUCLEO: protones de carga (+) y netrones (sin carga)
En la CORTEZA u ORBITAS: Electrones con carga (-)
El átomo mas simple se llama Hidrógeno, y tiene solo un protón en su núcleo y un electrón girando a su alrededor.
La carga del protón siempre es (+) y la del electrón (-), los neutrones no tienen carga eléctrica. Los protones van aumentando de uno en uno, y el siguiente elemento se llama Helio, dos protones y dos electrones, luego sigue el Litio con tres , y así se van sumando hasta el átomo mas complejo conocido como Uranio que contiene 92 protones en su núcleo, junto a 146 neutrones. Todos los átomo se puede agrupar ordenadamente en una tabla llamada Tabla Periódica de los Elementos Químicos, o bien , tabla de Mendeleiev, quien fue el autor de la misma. Actualmente se ha incrementado de forma artificial el numero de elementos químicos, llegando a 114.
Los átomos son neutros, porque hay tantas cargas positivas en el núcleo como cargas negativas en la "corteza" electrónica. Pero en las cercanías del átomo, una carga eléctrica es atraída en unas zonas y rechazada en otras: el átomo no actúa rigurosamente como neutro.
Por eso, cuando dos átomos están a distancias relativamente cercanas unos de otros (a pocos diámetros atómicos), ejercen atracciones y repulsiones entre ellos, según la estructura de cada átomo en particular.
Esas interacciones tienen como consecuencia que los átomos se reúnan en estructuras, algunas sumamente simples y otras sumamente complejas: las moléculas .
Estas son las estructuras más pequeñas en que las sustancias manifiestan sus propiedades químicas características: en que el agua es agua, la sal común es sal común, el oxígeno es oxígeno, el ácido sulfúrico es acido sulfúrico, etc.
LAS SUSTANCIAS PURAS SIMPLES:
Son las sustancias cuyas moléculas tienen una sola clase de átomos: sus nombres coinciden con los de los elementos químicos.
Estas moléculas pueden estar constituidas por diversos números de átomos: monoatómicas (como la plata, el cobre y los metales en general); diatómicas (como el oxígeno, el hidrógeno, el nitrógeno, y muchos otros gases); triatómicas (como el ozono).
Una molécula se representa con el símbolo químico y un número como subíndice de acuerdo con el número de átomos que forman la molécula: O3, Hz, Ag (en las monoatómicas se omite el subíndice), O3 (ozono), etc.
El estado (sólido, líquido o gaseoso) en que se encuentre una sustancia pura simple depende de las condiciones de temperatura y presión; y en condiciones normales hay sólo dos líquidas (mercurio y bromo), once gaseosas y el resto sólidas.
LAS SUSTANCIAS PURAS COMPUESTAS:
Cuando reaccionan dos o mas átomos entre sí para formar una sustancia, a dicha unión se la llama: molécula, y por lo tanto dicha molécula tienen varias clases de átomos: el agua, con dos átomos de hidrógeno y uno de oxígeno (H2O); la sal de cocina, o sal común, o cloruro de sodio, con un átomo de cloro y uno de sodio (NaCl); el ácido sulfúrico, con un átomo de azufre, cuatro de oxígeno y dos de hidrógeno (H2SO4); y otros innumerables ejemplos.
Como en la naturaleza todas las partículas están en movimiento, cuando dos o más átomos se chocan o se acercan suficientemente, actúan fuerzas eléctricas entre ellos.
Y cuando las condiciones son las necesarias y suficientes, los átomos se agrupan formando moléculas.
Una sustancia compuesta estará en estado sólido, líquido o gaseoso según las condiciones de temperatura y presión.
Pueden coexistir distintos estados, como en el agua: agua líquida en un arroyo mientras está nevando y hay trozos de- hielo en el suelo y vapor en la atmósfera; pero se están transformando unos estados en otros.
RESUMEN:
Si la materia se encuentra en estado puro, se denomina sustancia pura; éstas tienen siempre la misma composición y pueden ser elementos y compuestos.
Los elementos son sustancias que no pueden descomponerse en otras más sencillas por métodos químicos.
En la naturaleza existen 92 elementos en estado natural, los restantes han sido creados en el laboratorio. Éstos se encuentran organizados en la tabla periódica donde se han clasificado 114 elementos.
Cada clase de elemento se representa por un símbolo. El oxígeno es O; el hidrógeno es H, por ejemplo.
Los compuestos son sustancias formadas por la combinación de elementos. Los compuestos pueden descomponerse por métodos químicos en sus respectivos elementos.
Las propiedades de un compuesto son distintas de las propiedades de los elementos que lo forman.
Una molécula está formada por dos o más átomos.
Las moléculas pueden separarse químicamente.
Una molécula de agua está formada por dos átomos de hidrógeno y un átomo de oxígeno.
La división química de una molécula en otras moléculas más pequeñas o en átomos produce cambios en la composición y por lo tanto, cambio en las propiedades.
El agua es un compuesto formado por los elementos hidrógeno y oxígeno.
Cuando una corriente eléctrica fluye por el agua, la acción de la electricidad termina descomponiéndola en oxígeno e hidrógeno.
Es decir, en sus elementos.
La sal de cocina es un compuesto llamado cloruro de sodio. La molécula de sal está formada por los elementos cloro y sodio.
El oxígeno que respiramos es un compuesto formado por dos átomos del mismo elemento.
Hasta aquí hemos dicho que:
| MEZCLAS | |
SUSTANCIAS PURAS | |
| ELEMENTOS | COMPUESTOS |
Oxígeno | Agua |
Física Moderna: La Materia de Comporta Como Onda?
Fuente Consultada:
Enciclopedia CONSULTORA Tomo V Física - Los Estados de la Materia
QUIMICA I Sistemas Materiales y Estructura de la Materia Editorial Santillana - Alegria, Bosack, Dal Fávero y Otros