Dilatacion de un Gas a Presion Constante:Leyes y Ejemplos
Dilatacion de un Gas a Presion Constante:Leyes y Ejemplos
La temperatura es la expresión, para nuestros sentidos, del estado de agitación de las moléculas.
Por esta razón, existe un cero absoluto, que corresponde a las moléculas inmóviles, y más abajo del cual no se puede descender.
Con la elevación de temperatura las moléculas se mueven con mayor vigor y tienden a liberarse de las fuerzas que las unen: los solides funden y los líquidos hierven,
Al enfriar se repiten los mismos procesos en orden inverso, y desde el gas se llega hasta el sólido.
Con el incremento de temperatura todos los cuerpos se dilatan debido a que el mayor sacudimiento de sus moléculas los obliga a ocupar más espacio.
En los sólidos y los líquidos, que son prácticamente incompresibles, las variaciones de volumen son evidentes .
Pero los gases son muy elásticos; si el recipiente que los contiene es rígido, sólo se aprecia un aumento de presión, puesto que el gas no tiene posibilidad de dilatarse.
En notas ulteriores veremos la equivalencia entre temperatura y presión en los gases perfectos.
Un gas perfecto se distingue de un vapor en que sólo el segundo puede ser licuado, merced a un simple aumento de presión.
El gas perfecto necesita, además, ser enfriado hasta una temperatura llamada crítica para convertirse en vapor.
EJEMPLO PRÁCTICO DE DILATACIÓN
Los gasómetros clásicos reciben en forma continua el gas producido por la fábrica, y lo distribuyen de acuerdo con el consumo.
Se componen de un cilindro inferior fijo que recibe el gas y contiene cierta cantidad de agua; dentro de esta vaina se desliza, subiendo o bajando, un recipiente cilíndrico invertido, cuyo peso suministra la presión para las tuberías que distribuyen el fluido.
Cuando se acumula mucho gas, el recipiente está alto; cuando la reserva declina, el recipiente desciende y la altura del gasómetro disminuye.
En un gasómetro reina pues una presión constante, la que engendra el peso de su recipiente superior.
Se observa que si la temperatura se eleva en sólo dos grados, un gasómetro de 18 metros de altura crece en casi 13 cm.
Este fenómeno se debe a la dilatación del gas, y es fácil de calcular a base de las explicaciones impresas sobre fondo rosado: por cada grado que se suma el volumen aumenta en 1/273 del que ocupaba a 0°.
Basta multiplicar 18 metros por 2 grados y dividir por 273; para un cálculo más exacto se tendrá en cuenta las temperaturas ambientes, inicial y final. Recuérdese que el gasómetro se dilata sólo en altura, y no en las otras dos dimensiones.
En ciertos globos de juguete se enciende luego en la parte inferior para calentar el aire que contienen.
El gas caldeado y dilatado es menos denso que la atmósfera que lo rodea, y entonces el artefacto asciende.
La primera aeronave, la de los hermanos Montgolfier en 1783, se basaba en este principio.
La separación de las moléculas en el gas caliente y la consiguiente disminución de densidad, explica el ascenso del humo por las chimeneas.

►Globo Aerostático
Cuando un gas se calienta, sus moléculas se agitan y tienden a separarse.
Entonces, la masa gaseosa ocupa un volumen mayor, y, por ende, su peso específico (peso por unidad de volumen) disminuye.
De aqui que el aire caliente sea más liviano que el frío y ascienda, hecho fundamental en meteorología.
El primer viaje aéreo, el de los hermanos Montgolfier hace casi dos siglos, se basaba en este fenómeno.
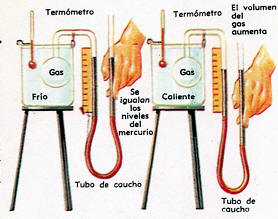
► Experimento con Gases
Figura Arriba: Experimento para medir la dilatación de un gas cuando la presión que soporta no se modifica.
Se sabe que dicha presión invariable se ha mantenido cuando las dos columnas de mercurio llegan a la misma altura, equilibrándose (si la presión del gas contenido en el matraz hubiera aumentado, empujaría al mercurio, en contacto con él).
Se logra igualar las columnas de mercurio mediante el tubo inferior, de caucho.
A la izquierda, el baño de agua es frió; a la derecha es caliente y el gas se dilata. Se restablece la presión anterior bajando la salida del tubo.
Las mediciones de temperatura y dilatación se llevan a cabo con un termómetro y una regla.
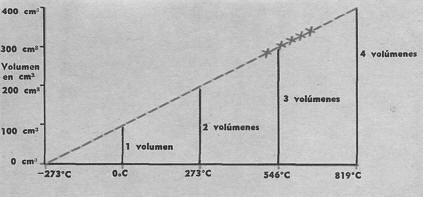
► Gráfica de gases
Hace un siglo y medio se midió empíricamente la dilatación de los gases a presión constante en la forma descrita en la figura 1.
La experiencia, que consiste esencialmente en calentar un .matraz de gas seco dentro de un baño e igualar las presiones inicial y final, muestra que el volumen de un gas a 0°C se duplica cuando llega a los 273 °C, se triplica a los 564°C (2 x 273), y así sucesivamente.
En suma, el coeficiente de dilatación de los gases es constante.
Los científicos de entonces dedujeron que si se enfriara un gas a 273°C bajo cero su volumen se anularía.
Denominaron a dicha temperatura "cero absoluto"; el gráfico muestra, hacia la izquierda, esta prolongación teórica de los resultados experimentales (técnicamente, la extensión gráfica se llama "extrapolación" de los resultados).
La ciencia moderna confirma casi exactamente el valor del cero o fría absoluto. Los especialistas suelen emplear la llamada "escala absoluta", que comienza en dicho punto, y entonces se habla de "grados Kelvin": por ejemplo 0°C es igual a 273°K, y así sucesivamente (basta sumar 273 a la temperatura ordinaria).
Pero es evidente que el volumen de un gas nunca puede reducirse a nada y, por añadidura, los gases se licuan antes de alcanzar el cero absoluto.
Si tomamos un gas sometido a presión constante en los instantes 1 y 2, y llamamos V1, V2, T1 y T2 los respectivos volúmenes y temperaturas, podemos expresar matemáticamente la ley que establece que el volumen de un gas varía en relación directa con la temperatura absoluta, con
la fórmula siguiente: V1/T1=V2/T2.
Esta ecuación, que traduce la proporcionalidad entre volúmenes y temperaturas., se utiliza con frecuencia.
Fuente Consultada:
Revista TECNIRAMA N°17.
FÍSICA II Polimodal.
CONSULTORA Enciclopedia Temática Ilustrada Tomo 10 El Mundo Físico.
Temas Relacionados:
Leyes de los Gases Ideales:Ley de Boyle, Lussac
Los Gases Nobles: Propiedades ,Aplicaciones y Concepto de Gas
Gas de Alumbrado Historia y Obtención del Gas de Hulla
Gas Natural Clasificación, Distribución, Transporte
Historia de la Lampara Electrica
El Negocio del Gas Natural en el Mundo
La Explotacion del Petroleo Busqueda Cientifica y Técnologica
Enlace Externo:• Valores de la constante de los gases






